Болезнь Уиппла
(код по МКБ-10: М07.6; К90.8†)
Болезнь Уиппла (БУ; Whipple disease, WD) представляет собой редкое хроническое системное инфекционное заболевание, которое начинается с поражения тонкого кишечника, вызываемого грам+ бактерией Tropheryma whippelei (от греч. trophi – пища и eryma – барьер).
Первое описание болезни под названием «интестинальная липодистрофия» дал американский патологоанатомом Джордж Уиппл (George H. Whipple) в 1907 году [23]. В публикации он привел данные аутопсии больного 35 лет, страдавшего диареей, стеатореей, значительным похуданием, лихорадкой, хроническим кашлем, накоплением жира в кишечнике и мезентериальных лимфатических узлах, мигрирующим артритом. Кроме того, Д. Уиппл выдвинул гипотезу об инфекционной причине болезни, однако ее возбудитель был выявлен с помощью полимеразной цепной реакции только в 1991-92 годах [18, 24], а культивирован в клеточной среде дезактивированых человеческих фагоцитов в 1997 году и в 2000 году в клеточной линии человеческих фибробластов (HEL) [6, 17].
Эпидемиология.
Преваленс БУ не изучался, ориентировочный инциденс заболевания составляет 0,5-1 на миллион населения [26]. Мужчины болеют значительно чаще женщин (♂ : ♀ = 5-10 : 1). Согласно данным патологоанатомических исследований частота БУ при аутопсиях составляет около 0,1% [8]. До 1987 года в литературе было описано около 1000 случаев БУ.
Эпидемиологи отмечают высокую контаминацию земли и сточных вод Tropheryma whippelei – она выявляется в 60-70% образцов, взятых из мест ее естественного обитания.
По данным нескольких эндоскопических исследований Tropheryma whippelei обнаруживали у 4% больных с различной патологией ЖКТ, у 1,5-7% здоровых лиц контрольной группы и у 12-25% работников очистных сооружений и животноводческих ферм [4, 26]. В слюне здоровых людей эту бактерию находили в 0,2-1,5% случаев [27, 28], а ДНК этой бактерии была выявлена у 40% здоровых лиц в сублингвальных бляшках, десневых карманах, зубных протезах [25]. Учитывая эти данные, путь заражения Tropheryma whippelei, вероятнее всего, фекально-оральный или орально-оральный.
Патогенез.
Tropheryma whippelei относится к таксону актиномицеты [18, 24]. По данным электронной микроскопии бактерия имеет трехслойную клеточную стенку и единственную кольцевую хромосому. Tropheryma whippelei является внутриклеточной бактерией с тропизмом к моноцитам и макрофагам, а также к внеклеточным средам с высокой метаболической активностью. Из-за снижения уровня интегрина-альфа (CD11b; альфа-цепь фагоцитарного рецептора CR3) нарушается способность макрофагов, но не моноцитов) к лизису бактерий. Репликация Tropheryma whippelei ассоциирована с апоптозом макрофагов (»20% клеток становятся аннексин-V-позитивными), что сопровождается усилением продукции ИЛ-1b. Ускорение апоптоза макрофагов является ключевым моментом при диссеминации возбудителя БУ.
Бактерии также можно обнаружить во внеклеточном пространстве, что является признаком диссеминации возбудителя. С иммунологической точки зрения «болезнь Уиппла» – это «болезнь макрофагов», точнее особенности взаимодействия Tropheryma whippelei с дефектными макрофагами.
Для развития БУ недостаточно проникновения бактерии в подслизистую тонкого кишечника. Заболевание возникает только на фоне нарушений иммунитета инфицированного человека: нарушается функция Т1-хелперов (Th1) и их взаимодействие с макрофагами; уменьшается иммунорегуляторный индекс (CD4+/CD8+); подавляется продукция ИЛ-12 в моноцитах, макрофагах и дендритных клетках, стимулирующего, в свою очередь, синтез интерферона-гамма (INF-g) натуральными киллерами и Th1 [6, 26]. ИЛ-12 играет ключевую роль в дифференциации Th1, а также в поддержании INF-g-зависимой способности моноцитов и макрофагов к лизису именно Tropheryma whippelei.
Размножение Tropheryma whippelei в интестинальных макрофагах, в отличие от моноцитов периферической крови, сопровождается усилением экспрессии ИЛ-16, обладающего провоспалительной активностью, а также способностью стимулировать другие провоспалительные цитокины (TNF-a, IL-1b, IL-6 и IL-15), поэтому ИЛ-16 признается ключевым цитокином в патогенезе БУ. Уровень сывороточного ИЛ-16 и выраженность апоптоза прямо пропорционально коррелируют с активностью БУ [26]. Длительная рациональная антибиотикотерапия приводит к нормализации уровня ИЛ-16 [6].
При БУ происходит дифференцированная модуляция активности более 120 генов: катепсинов, хемокинов, молекул II класса главного комплекса гистосовместимости (HLA-DPb1 и HLA-DMB), рецепторов макрофагов, CD14, IL-1 и др.). Среди них есть ген, кодирующий хемокин CCL18 (chemokine ligand 18 или C-C motif ligand 18), который экспрессируется преимущественно моноцитами, макрофагами и дендритными клетками. Экспрессия этого хемокина активизируется Th2-ассоциированными цитокинами (IL-4, IL-13 и IL-10), а подавляется – IFN-g.
В ряде исследований было показано, что в тонком кишечнике при БУ отчетливо повышается продукция ИЛ-10, который стимулирует экспрессию CCL18 макрофагами в зоне воспаления. Далее CCL18 привлекает в эту зону «наивные» Т-клетки, которые ингибируют созревание дендритных клеток, в результате чего развивается толерантность к бактерии.
Модуляция активности генов катепсинов происходит в зонах воспаления под влиянием IFN-g, который уменьшает продукцию катепсина В макрофагами и скорость их апоптоза. Это положение является обоснованием для назначения интерферона-гамма при рефрактерной БУ [21].
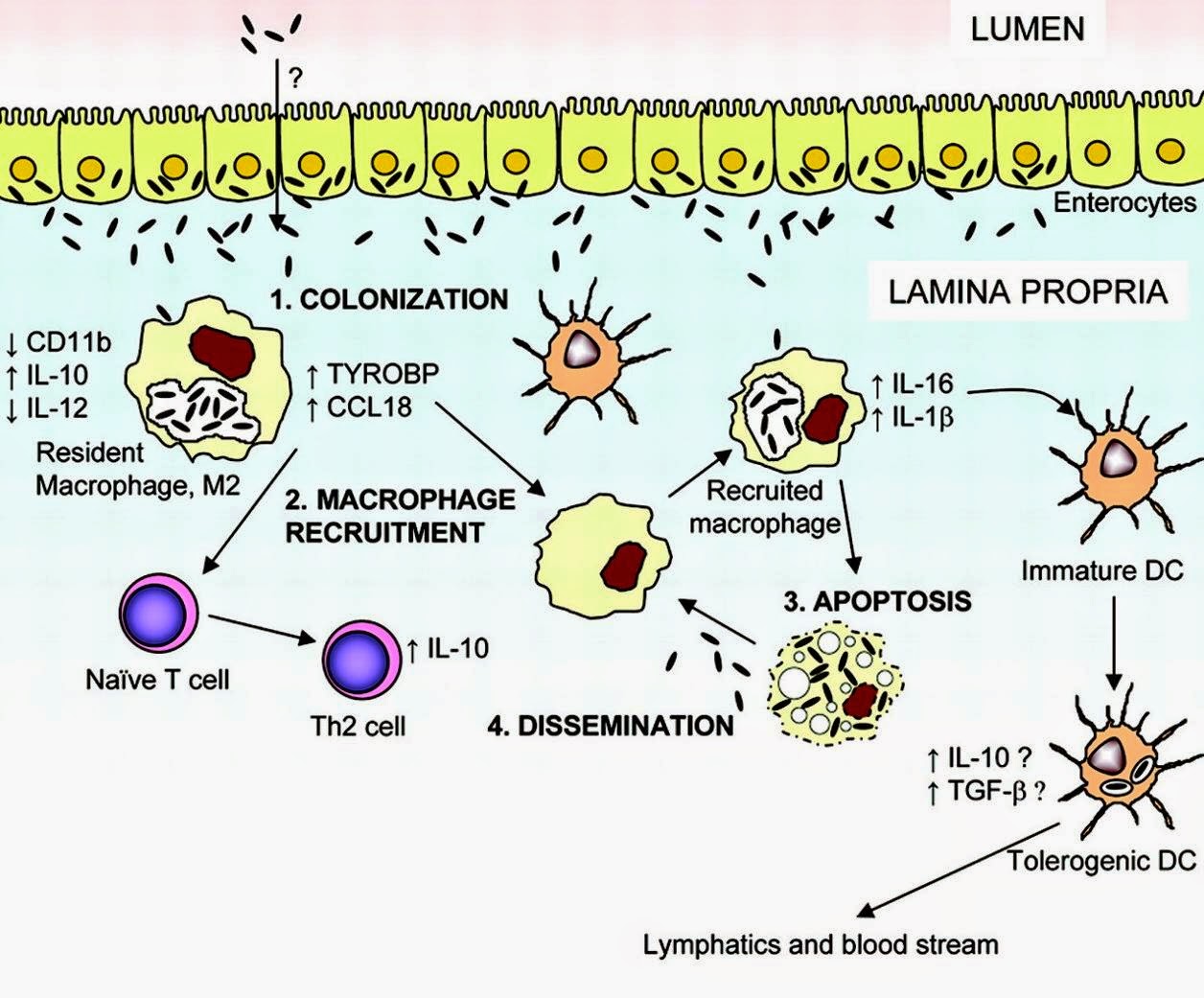
Указанные выше активированные гены ассоциированы с М2-фенотипом макрофагов (М2-макрофаги или противовоспалительные макрофаги; М1-макрофаги или провоспалительные макрофаги). Для этих интестинальных М2-макрофагов, которые отличаются от циркулирующих в крови моноцитов, регулирующее влияние ИЛ-16 имеет ключевое значение. Иммунологические звенья патогенеза БУ представлены на рисунке [6]. С помощью неизвестного пока механизма Tropheryma whippelei проникает сквозь слизистую оболочку тонкого кишечника и достигает собственной пластинки, где поглощается интестинальными макрофагами, которые приобретают М2-фенотип. Последние продуцируют CCL18, IL-10 и TYRO binding protein или DAP12. Эти цитокины усиливают хемотаксис других макрофагов и «наивных» Т-клеток в зону поражения и ориентируют локальный иммунный ответ по гуморальному Th2-типу. Новые макрофаги также поглощают бактерии, продуцируют ИЛ-16 и ИЛ-1b и подвергаются апоптозу, что ведет к диссеминации бактерии в подслизистом слое. Апоптоз инвазированных клеток имеет значение и в индукции противовоспалительных цитокинов, продуцируемых макрофагами в процессе фагоцитоза.
В слизистой тонкого кишечника ИЛ-16 способствует созреванию незрелых дендритных клеток в дендритные клетки, вызывающие иммунологическую толерантность к Tropheryma whippelei. Миграция инфицированных дендритных клеток и лимфоцитов ведет к распространению бактерии по лимфатической системе.
Известно также, что БУ вызывают лишь определенные штаммы Tropheryma whippelei, а их обнаружено более 100 [26]. Возможно бессимптомное носительство инфекции, что способствует широкому распространению бактерии.
Фактор восприимчивости к Tropheryma whippelei у некоторых лиц, по всей вероятности, весьма специфичен, так как другие инфекционные заболевания встречаются у них столь же часто, как и в наблюдаемой популяции. Исключеним является лишь диарея на фоне лямблиоза (giardiasis), которую вызывает представитель простейших Giardia lamblia.
Описаны редкие случаи семейной агрегации БУ [16]. В ряде исследований установлена генетическая предрасположенность к развитию БУ. Так, в разных популяциях в 25-35% случаев болезнь ассоциирована с HLA-B27, поэтому ее, наряду болезнью Крона и неспецифическим язвенным колитом, включают в «болезни круга HLA-В27» [8, 29]. В более поздних исследованиях, однако, эта ассоциация не была подтверждена, но установлена слабая ассоциация с аллелями DRB1*13 и DQB1*06 [26].
На органном уровне БУ обусловлена окклюзией лимфатических сосудов и узлов тонкой кишки бактериальными мукополисахаридными комплексами. В лимфатических узлах выявляют пенистые макрофаги.
Выраженный синдром мальабсорбции объясняют сдавлением макрофагальными инфильтратами лимфатических сосудов и уменьшением количества ворсинок, что нарушает транспорт питательных веществ. При дальнейшей генерализации инфекции в патологический процесс вовлекаются печень, легкие, сердце, суставы, нервная система – практически любой орган инфицированного человека может стать мишенью для Tropheryma whippelei.
Несмотря на неизмененные процессы гидролиза питательных веществ, инфильтрация бактериями собственного слоя слизистой оболочки тонкой кишки приводит к блокированию поступления питательных веществ, прежде всего жиров, и накоплению капелек липидов в собственной пластинке, что послужило поводом для второго названия заболевания – «интестинальная липодистрофия». В дальнейшем нарушается всасывание белков, углеводов, витаминов и минеральных веществ. что ведет развитию синдрома мальабсорбции, который проявляется выраженным клиническим полиморфизмом.
Клиника.
В течении БУ выделяют следующие стадии:
Диагностика.
БУ – заболевание хамелеон, имеющее много клинических масок как в дебюте, так и при манифестации патологического процесса, поэтому ранняя диагностика болезни вызывает значительные затруднения.
Лечение.
До окончательного выяснения этиологии БУ, а это произошло чуть более 20 лет назад, заболевание считалось неизлечимым. Диагноз устанавливался обычно во второй стадии болезни, то есть спустя 5-10 лет от появления первых симптомов. Больные умирали через 1-2 года после появления манифестной клинической картины: тяжелая желудочно-кишечная диспепсия, синдром мальабсорбции, кахексия, поражение внутренних органов.
Случай из практики 1 [1].
Больной А., 23 года, в течение последних двух лет предъявлял жалобы на боли в суставах, в том числе локтевых и лучезапястных, которые сопровождались повышением температуры тела до 37,1-37,8°С. Наблюдался у квалифицированного ревматолога с диагнозом «ревматоидный артрит».
Случай из практики 2 [13].
Мужчина 60 лет поступил в клинику в марте 2008 года. В течение последних 14 лет неоднократно госпитализировался в отделение ревматологии в связи с рецидивами полиартрита и лихорадки. При поступлении передвигался с помощью костылей. Симптомы желудочно-кишечной диспепсии отсутствовали. Первый эпизод артралгии был зарегистрирован в 1994 году. Наблюдался с диагнозом серонегативный спондилоартрит (suspitio ревматоидный артрит). В течение 4 лет принимал НПВП, которые уменьшали болевой синдром и сокращали периоды обострений. В 2000 году развился полиартрит с поражением крупных и средних суставов конечностей, выраженным болевым синдромом, утренней скованностью. Был выставлен диагноз «серонегативный ревматоидный полиартрит» и назначены глюкокортикостероиды (ГКС) и НПВП. В 2001 году присоединились миалгии, полинейропатия. Лабораторные данные: сдвиг лейкоцитарной формулы влево, лимфоцитопения, СОЭW 75 мм/ч, СРБ 45 мг/л, гемоглобин 121 г/л, сывороточное железо 27 μг/100 мл, фибриноген 600 мг/100 мл, C3 141 мг/100 мл, C4 25 мг/100 мл, РФ и АНА не обнаружены. Проведено эндоскопическое исследование желудка и 12-перстной кишки. В биоптате слизистой нисходящего отдела 12-перстной кишки в зоне собственной пластинки обнаружены PAS-позитивные пенистые макрофаги и депозиты липидов. Эти данные позволили диагностировать БУ без гастроинтестинальных проявлений. Назначены: доксициклин 100 мг 2 раза в день, метилпреднизолон 8 мг в день, метотрексат 5 мг в неделю. Антибиотикотерапия была продолжена амбулаторно в течение 4 месяцев. Получен положительный эффект с быстрым выходом на ремиссию в течение 3 лет. В 2004 и 2006 годах развились обострения суставного синдрома, которые были купированы метилпреднизолоном и циклофосфамидом.
Случай из практики 3 [2].
Мужчина средних лет считает себя больным с ноября 2001 г., когда появились геморрагические высыпания на ногах, боли в голеностопных суставах. Наблюдался в поликлинике по месту жительства с диагнозом «геморрагический васкулит» (диклофенак 7 дней). На этом фоне стали нарастать отеки нижних конечностей и больной прекратил прием препарата. Затем появились слабость, поносы после приема пищи и в ночное время до 10 раз в сутки, урчание, вздутие живота, стал терять в весе. В апреле 2002 г. самочувствие резко ухудшилось, стали беспокоить головокружения, прогрессировала слабость. Госпитализирован в клинику, где находился с 05.04.2002 по 07.06.2002 г., с подозрением на желудочно-кишечное кровотечение. Выписан с диагнозом «железодефицитная постгеморрагическая анемия»; синдром мальабсорбции с гиперкатаболическим синдромом и экссудативной энтеропатией (безбелковые отеки, асцит, анасарка, гидроторакс). Лечение: препараты железа, витамин В12, фолиевая кислота, аспаркам, ампициллин, лоперамидом, панкреатином, одногруппная свежезамороженная плазма, эритроцитарная масса, аминокровин. Состояние больного улучшилось: уменьшилась слабость, исчезли периферические отеки, купирована диарея, стабилизирована масса тела. При выписке: гемоглобин – 67 г/л; общий белок – 45,7 г/л; альбумин – 30,9 г/л; сывороточное железо – 2,47 ммоль/л; остальные показатели – в пределах нормы. Амбулаторно: препараты железа, фолиевая кислота, витамин В12. Через 3 недели наступило ухудшение состояния: слабость, боли в животе, частый жидкий стул. Госпитализирован. Лечение: антибактериальная терапия, препараты железа. Выписан из стационара с прежним диагнозом (гемоглобин 75 г/л; сывороточное железо составляло 7,2 ммоль/л). Амбулаторно: препараты железа, панкреатин. С 15.12.2002 г. резкая слабость, головокружение, боли в животе, диарея, боли в коленных и голеностопных суставах – с трудом передвигался. В начале января 2003 г. госпитализирован диагнозом «железодефицитная анемия». Вредных привычек не имел. Наследственность не отягощена. Аллергологический анамнез без особенностей.
Литература
1. Дорофеев, А.Э. Болезнь Уиппла: клиника, диагностика, лечение / А.Э. Дорофеев, О.А. Рассохина // Новости медицины и фармации. Гастроэнтерология (Украина). – 2011. – № 358. – С. 3-4.
Болезнь Уиппла (БУ; Whipple disease, WD) представляет собой редкое хроническое системное инфекционное заболевание, которое начинается с поражения тонкого кишечника, вызываемого грам+ бактерией Tropheryma whippelei (от греч. trophi – пища и eryma – барьер).
Первое описание болезни под названием «интестинальная липодистрофия» дал американский патологоанатомом Джордж Уиппл (George H. Whipple) в 1907 году [23]. В публикации он привел данные аутопсии больного 35 лет, страдавшего диареей, стеатореей, значительным похуданием, лихорадкой, хроническим кашлем, накоплением жира в кишечнике и мезентериальных лимфатических узлах, мигрирующим артритом. Кроме того, Д. Уиппл выдвинул гипотезу об инфекционной причине болезни, однако ее возбудитель был выявлен с помощью полимеразной цепной реакции только в 1991-92 годах [18, 24], а культивирован в клеточной среде дезактивированых человеческих фагоцитов в 1997 году и в 2000 году в клеточной линии человеческих фибробластов (HEL) [6, 17].
Эпидемиология.
Преваленс БУ не изучался, ориентировочный инциденс заболевания составляет 0,5-1 на миллион населения [26]. Мужчины болеют значительно чаще женщин (♂ : ♀ = 5-10 : 1). Согласно данным патологоанатомических исследований частота БУ при аутопсиях составляет около 0,1% [8]. До 1987 года в литературе было описано около 1000 случаев БУ.
Эпидемиологи отмечают высокую контаминацию земли и сточных вод Tropheryma whippelei – она выявляется в 60-70% образцов, взятых из мест ее естественного обитания.
По данным нескольких эндоскопических исследований Tropheryma whippelei обнаруживали у 4% больных с различной патологией ЖКТ, у 1,5-7% здоровых лиц контрольной группы и у 12-25% работников очистных сооружений и животноводческих ферм [4, 26]. В слюне здоровых людей эту бактерию находили в 0,2-1,5% случаев [27, 28], а ДНК этой бактерии была выявлена у 40% здоровых лиц в сублингвальных бляшках, десневых карманах, зубных протезах [25]. Учитывая эти данные, путь заражения Tropheryma whippelei, вероятнее всего, фекально-оральный или орально-оральный.
Патогенез.
Tropheryma whippelei относится к таксону актиномицеты [18, 24]. По данным электронной микроскопии бактерия имеет трехслойную клеточную стенку и единственную кольцевую хромосому. Tropheryma whippelei является внутриклеточной бактерией с тропизмом к моноцитам и макрофагам, а также к внеклеточным средам с высокой метаболической активностью. Из-за снижения уровня интегрина-альфа (CD11b; альфа-цепь фагоцитарного рецептора CR3) нарушается способность макрофагов, но не моноцитов) к лизису бактерий. Репликация Tropheryma whippelei ассоциирована с апоптозом макрофагов (»20% клеток становятся аннексин-V-позитивными), что сопровождается усилением продукции ИЛ-1b. Ускорение апоптоза макрофагов является ключевым моментом при диссеминации возбудителя БУ.
Бактерии также можно обнаружить во внеклеточном пространстве, что является признаком диссеминации возбудителя. С иммунологической точки зрения «болезнь Уиппла» – это «болезнь макрофагов», точнее особенности взаимодействия Tropheryma whippelei с дефектными макрофагами.
Для развития БУ недостаточно проникновения бактерии в подслизистую тонкого кишечника. Заболевание возникает только на фоне нарушений иммунитета инфицированного человека: нарушается функция Т1-хелперов (Th1) и их взаимодействие с макрофагами; уменьшается иммунорегуляторный индекс (CD4+/CD8+); подавляется продукция ИЛ-12 в моноцитах, макрофагах и дендритных клетках, стимулирующего, в свою очередь, синтез интерферона-гамма (INF-g) натуральными киллерами и Th1 [6, 26]. ИЛ-12 играет ключевую роль в дифференциации Th1, а также в поддержании INF-g-зависимой способности моноцитов и макрофагов к лизису именно Tropheryma whippelei.
Размножение Tropheryma whippelei в интестинальных макрофагах, в отличие от моноцитов периферической крови, сопровождается усилением экспрессии ИЛ-16, обладающего провоспалительной активностью, а также способностью стимулировать другие провоспалительные цитокины (TNF-a, IL-1b, IL-6 и IL-15), поэтому ИЛ-16 признается ключевым цитокином в патогенезе БУ. Уровень сывороточного ИЛ-16 и выраженность апоптоза прямо пропорционально коррелируют с активностью БУ [26]. Длительная рациональная антибиотикотерапия приводит к нормализации уровня ИЛ-16 [6].
При БУ происходит дифференцированная модуляция активности более 120 генов: катепсинов, хемокинов, молекул II класса главного комплекса гистосовместимости (HLA-DPb1 и HLA-DMB), рецепторов макрофагов, CD14, IL-1 и др.). Среди них есть ген, кодирующий хемокин CCL18 (chemokine ligand 18 или C-C motif ligand 18), который экспрессируется преимущественно моноцитами, макрофагами и дендритными клетками. Экспрессия этого хемокина активизируется Th2-ассоциированными цитокинами (IL-4, IL-13 и IL-10), а подавляется – IFN-g.
В ряде исследований было показано, что в тонком кишечнике при БУ отчетливо повышается продукция ИЛ-10, который стимулирует экспрессию CCL18 макрофагами в зоне воспаления. Далее CCL18 привлекает в эту зону «наивные» Т-клетки, которые ингибируют созревание дендритных клеток, в результате чего развивается толерантность к бактерии.
Модуляция активности генов катепсинов происходит в зонах воспаления под влиянием IFN-g, который уменьшает продукцию катепсина В макрофагами и скорость их апоптоза. Это положение является обоснованием для назначения интерферона-гамма при рефрактерной БУ [21].
Указанные выше активированные гены ассоциированы с М2-фенотипом макрофагов (М2-макрофаги или противовоспалительные макрофаги; М1-макрофаги или провоспалительные макрофаги). Для этих интестинальных М2-макрофагов, которые отличаются от циркулирующих в крови моноцитов, регулирующее влияние ИЛ-16 имеет ключевое значение. Иммунологические звенья патогенеза БУ представлены на рисунке [6]. С помощью неизвестного пока механизма Tropheryma whippelei проникает сквозь слизистую оболочку тонкого кишечника и достигает собственной пластинки, где поглощается интестинальными макрофагами, которые приобретают М2-фенотип. Последние продуцируют CCL18, IL-10 и TYRO binding protein или DAP12. Эти цитокины усиливают хемотаксис других макрофагов и «наивных» Т-клеток в зону поражения и ориентируют локальный иммунный ответ по гуморальному Th2-типу. Новые макрофаги также поглощают бактерии, продуцируют ИЛ-16 и ИЛ-1b и подвергаются апоптозу, что ведет к диссеминации бактерии в подслизистом слое. Апоптоз инвазированных клеток имеет значение и в индукции противовоспалительных цитокинов, продуцируемых макрофагами в процессе фагоцитоза.
Рисунок – Патологическая физиология болезни Уиппла [6].
В слизистой тонкого кишечника ИЛ-16 способствует созреванию незрелых дендритных клеток в дендритные клетки, вызывающие иммунологическую толерантность к Tropheryma whippelei. Миграция инфицированных дендритных клеток и лимфоцитов ведет к распространению бактерии по лимфатической системе.
Известно также, что БУ вызывают лишь определенные штаммы Tropheryma whippelei, а их обнаружено более 100 [26]. Возможно бессимптомное носительство инфекции, что способствует широкому распространению бактерии.
Фактор восприимчивости к Tropheryma whippelei у некоторых лиц, по всей вероятности, весьма специфичен, так как другие инфекционные заболевания встречаются у них столь же часто, как и в наблюдаемой популяции. Исключеним является лишь диарея на фоне лямблиоза (giardiasis), которую вызывает представитель простейших Giardia lamblia.
Описаны редкие случаи семейной агрегации БУ [16]. В ряде исследований установлена генетическая предрасположенность к развитию БУ. Так, в разных популяциях в 25-35% случаев болезнь ассоциирована с HLA-B27, поэтому ее, наряду болезнью Крона и неспецифическим язвенным колитом, включают в «болезни круга HLA-В27» [8, 29]. В более поздних исследованиях, однако, эта ассоциация не была подтверждена, но установлена слабая ассоциация с аллелями DRB1*13 и DQB1*06 [26].
На органном уровне БУ обусловлена окклюзией лимфатических сосудов и узлов тонкой кишки бактериальными мукополисахаридными комплексами. В лимфатических узлах выявляют пенистые макрофаги.
Выраженный синдром мальабсорбции объясняют сдавлением макрофагальными инфильтратами лимфатических сосудов и уменьшением количества ворсинок, что нарушает транспорт питательных веществ. При дальнейшей генерализации инфекции в патологический процесс вовлекаются печень, легкие, сердце, суставы, нервная система – практически любой орган инфицированного человека может стать мишенью для Tropheryma whippelei.
Несмотря на неизмененные процессы гидролиза питательных веществ, инфильтрация бактериями собственного слоя слизистой оболочки тонкой кишки приводит к блокированию поступления питательных веществ, прежде всего жиров, и накоплению капелек липидов в собственной пластинке, что послужило поводом для второго названия заболевания – «интестинальная липодистрофия». В дальнейшем нарушается всасывание белков, углеводов, витаминов и минеральных веществ. что ведет развитию синдрома мальабсорбции, который проявляется выраженным клиническим полиморфизмом.
Клиника.
В течении БУ выделяют следующие стадии:
- стадия I (продром) – артралгия, артрит, лихорадка;
- стадия II – диарея, потеря массы тела, нарушения всасывания питательных веществ (белковая недостаточность, признаки гиповитаминоза);
- стадия III – системные проявления (неврологическая симптоматика, эндокардит, перикардит, полисерозит).
Частота клинических проявлений БУ по объединенным данным нескольких обзоров представлена в таблице [6]. Средняя продолжительность продромального периода около 5 лет, однако он значительно укорачивается в случаях, когда в лечении «хронической артропатии» начинают использовать глюкокортикостероиды, иммунодепрессанты, генно-инженерные биологические препараты (например, инфликсимаб) [11].
Поражение суставов у 50-70% больных может наблюдаться до развития кишечных и системных проявлений заболевания [5]: мигрирующие артралгии или артриты с поражением крупных и средних периферических суставов (коленных, голеностопных, лучезапястных), у 5-10% больных поражаются суставы позвоночника и крестцово-подвздошные сочленения (чаще при наличии HLA-B27). По характеру суставного синдрома может быть констатирован диагноз «полиндромный ревматизм» – длительность артропатии от нескольких часов до нескольких дней, спонтанное разрешение, отсутствие рентгенологических изменений в пораженных суставах. Менее часто серонегативный артрит при БУ расценивается как ревматоидный артрит. У некоторых больных обнаруживаются подкожные узелки. При длительной течении болезни без адекватной антибактериальной терапии возможно рентгенологические проявления вторичного остеоартроза (сужение суставных щелей субхондральный остеосклероз, остеофитоз, субхондральные кисты). В 6-40% случаев в процесс вовлекается позвоночник и крестцово-подвздошные сочленения (спондилоартрит, спондилит, синдесмофиты, сакроартроз)
Из клинического опыта следует, что в тех случаях, когда интермиттирующая мигрирующая артропатия, а также серонегативный поли- или олигоартрит выявляется в мужчины средних лет, то, даже в отсутствие гастроинтестинальных проявлений, необходимо исключать БУ.
Таблица – Частота клинических проявлений БУ
Поражение суставов у 50-70% больных может наблюдаться до развития кишечных и системных проявлений заболевания [5]: мигрирующие артралгии или артриты с поражением крупных и средних периферических суставов (коленных, голеностопных, лучезапястных), у 5-10% больных поражаются суставы позвоночника и крестцово-подвздошные сочленения (чаще при наличии HLA-B27). По характеру суставного синдрома может быть констатирован диагноз «полиндромный ревматизм» – длительность артропатии от нескольких часов до нескольких дней, спонтанное разрешение, отсутствие рентгенологических изменений в пораженных суставах. Менее часто серонегативный артрит при БУ расценивается как ревматоидный артрит. У некоторых больных обнаруживаются подкожные узелки. При длительной течении болезни без адекватной антибактериальной терапии возможно рентгенологические проявления вторичного остеоартроза (сужение суставных щелей субхондральный остеосклероз, остеофитоз, субхондральные кисты). В 6-40% случаев в процесс вовлекается позвоночник и крестцово-подвздошные сочленения (спондилоартрит, спондилит, синдесмофиты, сакроартроз)
Из клинического опыта следует, что в тех случаях, когда интермиттирующая мигрирующая артропатия, а также серонегативный поли- или олигоартрит выявляется в мужчины средних лет, то, даже в отсутствие гастроинтестинальных проявлений, необходимо исключать БУ.
Таблица – Частота клинических проявлений БУ
Демографические
параметры
|
Данные
|
Число случаев
|
1000
|
Средний возраст
|
50 лет
|
Гендерный индекс (♂ :
♀)
|
8
|
Случаи повторных заболеваний в
семьях
|
Редко
|
Важнейшие
клинические проявления
|
%
|
Похудание
|
90
|
Диарея
|
75
|
Артропатия
|
85
|
Абдоминальная
боль
|
60
|
Другие
симптомы
|
%
|
Артралгия, артрит
|
70-90
|
Анемия
|
75-90
|
Лихорадка
|
45
|
Ночная потливость
|
45
|
Лимфаденопатия
|
40-50
|
Гиперпигментация, меланодермия
|
40-60
|
Поражение сердца
|
35-65
|
Поражение бронхов и легких
|
35-60
|
Поражение ЦНС
|
20-30
|
Кишечное кровотечение
|
20-30
|
Поражение глаз
|
5-15
|
Спленомегалия
|
5-10
|
Асцит
|
5
|
Хроническая диарея, похудание, лихорадка наблюдаются в клинической картине развернутой стадии БУ у 85% больных – обычна этой стадии устанавливается диагноз заболевания. Типичными кишечными проявлениями БУ являются: частота дефекации 10 и более раз в сутки, полифекалия, стеаторея, креаторея, амилорея. Возможен дегтеобразный стул, обусловленный снижением всасывания витамина К. Абдоминальная боль носит приступообразный характер, локализуется преимущественно возле пупка, отмечается метеоризм. Наблюдается также и желудочная диспепсия: тошнота, иногда рвота. Характерным признаком БУ является генерализованная лимфаденопатия (лимфоузлы подвижны и безболезненны).
В третьей стадии болезни преобладают множественные внекишечные проявления:
- поражение кожи – узловатая эритема;
- поражение глаз – увеит, ретинит, кератит;
- поражение сердечно-сосудистой системы – эндокардит, миокардит, перикардит, коронарит;
- поражение легких – бронхит, плеврит, увеличение лимфоузлов средостения синдромом сдавления трахеи и бронхов;
- симптомы надпочечниковой недостаточности: низкое АД, пигментация кожи, анорексия, гипонатриемия, гипогликемия;
- поражение центральной и периферической нервной системы – нарушение слуха, зрения, деменция, судорожные припадки, атаксия, поражение черепных нервов, полинейропатия.
Необходимо подчеркнуть, что поражение внутренних органов (сердца, ЦНС, периферческих суставов и позвоночника, глаз) может протекать без клинических проявлений состороны кишечника [26].
Синдром мальабсорбции проявляется выраженным множественным гипо- и авитаминозом: 1) недостаток тиамина – парестезии в области конечностей, бессонница; 2) дефицит никотиновой кислоты – глоссит, гингивит стоматит, фотосенсибилизация, дерматит, гипер- и депигментация кожи; 3) снижение уровня рибофлавина – хейлит, ангулярный стоматит; 4) недостаток аскорбиновой кислоты – кровоточивость десен, петехиальная сыпь; 5) дефицит витамина А – гемералопия (нарушение сумеречного зрения); 6) дефицит витамина В12, фолиевой кислоты – анемия.
У больных могут наблюдаться остеопороз и переломы костей, остеомаляция, судороги мышц. Гипопротеинемия и нарушение обмена электролитов ведут к отекам, сухости кожи, жажде, миалгиям, атрофии мышц, ослаблению сухожильных рефлексов, нарушениям сердечного ритма, артериальная гипотонии [14].
Изменения эндокринных органов проявляются нарушением менструального цикла, недостаточностью надпочечников и других органов эндокринной системы.
У 35-50% больных выявляется разнообразные поражения ЦНС и их сочетания (офтальмоплегия, миоклония, деменция), прогрессирование которых свидетельствует о неблагоприятном прогнозе.
Эндомиокардит и перикардит отмечаются у 25-35% больных. Эндокардит нередко протекает без лихорадки, с отрицательной гемокультурой (в том числе и на культурах клеток крови), преимущественным фиброзным поражением митрального клапана и, существенно реже, аортального клапана [19]. Серозно-фибринозный перикардит обычно протекает бессимптомно и выявляется при Эхо-КГ. Описаны случаи стенокардии из-за коронарита.
Поражение бронхолегочной системы в виде бронхита или плеврита развивается у 30-50 % больных. Увеличение лимфоузлов средостения приводит к сдавлению трахеи, сухому кашлю, одышке, изредка к удушью.
Диагностика.
БУ – заболевание хамелеон, имеющее много клинических масок как в дебюте, так и при манифестации патологического процесса, поэтому ранняя диагностика болезни вызывает значительные затруднения.
Клинические ситуации, при которых следует думать о возмосжности БУ [26]: необъяснимый рецидивирующий артрит, хронический серонегативный полиартрит без поражения мелких суставов кистей и стоп, появление внесуставных симтомов (кишечных, кардиальных, неврологических, лихорадки) после лечения гиенно-инженерными биологическими препаратами (биоагентами), длительная неуточненная лихорадка, необъяснимая неврологическая симтоматика, рецидивирующие увеиты, эндокардит с отрицательной гемокультурой, выявление неказиозной эпителиальной гиганто-клеточной гранулемы и лимфогранулемы.
Для верификации диагноза БУ необходимо морфологическое исследование биоптатов (³5) из разных отделов слизистой оболочки постбульбарного отдела 12-перстной кишки и проксимального отдела тонкой кишки. При эндоскопии выявляются: 1) отечность и эрозии бледно-желтой рыхлой слизистой оболочки 12-перстной кишки; 2) неравномерное утолщение складок слизистой кишки из-за лимфостаза; 3) многочисленные возвышающиеся образования светло-желтого цвета (бляшки) вследствие внутри- и внеклеточного отложении липидов в слизистой оболочке тонкой кишки.
При исследовании биоптатов выявляются укорочение и утолщение ворсинок, булавовидные ворсинки вследствие расширения лимфатических сосудов. В собственной пластинке слизистой оболочки обнаруживаются много макрофагов (до 80% всех клеток) с гликопротеиновыми гранулами в виде пенистой цитоплазмы, дающими положительную реакцию с Шифф-йодной кислотой (periodic acid Schiff reaction, PAS-реакция, ШИК-реакция). До разработки ПЦР-диагностики Tropheryma whippelei этот гистологический признак являлся ключевым критерием БУ [17], но он может наблюдаться при коринебактериозе, саркоидозе, гистоплазмозе, микозах, инфицировании Mycobacterium avium (окраска по Циль-Нильсену позволяет дифференцировать эти 2 микроорганизма – включения, содержащие Tropheryma whippelei, не окрашиваются). Пенистые макрофаги обнаруживают также в мезентериальных лимфоузлах, спинномозговой жидкости, сердце, желудке, печени, мышцах, бронхолегочной системе, синовиальной оболочке, костном мозге, что отражает системность процесса. В пораженных тканях вблизи сосудов могут обнаруживаться мелкие палочковидные бактерии.
При хронизации болезни вероятность идентификации возбудителя зависит от места взятия биоптата и проведенной антибиотикотерапии, поэтому существенно более точным является ПЦР-диагностика БУ, позволяющая идентифицировать ДНК Tropheryma whippelei как в биоптатах, так и в других биологических средах [12, 15, 18]. Специфичность определения ДНК Tropheryma whippelei в кале составляет 93% [12].
Необходимо подчеркнуть, что в литературе описаны случаи БУ с ПЦР-негативным тестом и, наоборот, ПЦР-положительный тест у лиц без БУ. Поэтому рекомендуется при постановке диагноза учитывать клинику, данные гистоморфологического исследования биоптатов слизистой 12-перстной кишки, электронной микроскопии (выявление характерной трехслойной мембраны бактерии) и ПЦР-диагностики.
Серологические методы диагностики БУ используются редко, так как антитела к антигенам Tropheryma whippelei одинаково часто встречаются как у здоровых лиц, так и у пациентов с БУ. Однако иммуногистохимические исследования различных биологических сред с использованием поликлональных кроличьих антител к Tropheryma whippelei считаются весьма полезными [9]. Кроме того, для иммуногистохимических исследований используют естественные антитела к Tropheryma whippelei, полученные от нескольких пациентов с БУ.
В общем анализе крови отмечается ускорение СОЭ, умеренные лейкоцитоз, тромбоцитоз, анемия, возможны эозинофилия и тромбоцитопения; в биохимическом анализе крови – гипопротеинемия (гипоальбуминемия), снижение уровней железа, кальция, холестерина. Исследования кала включают в себя тест на скрытую кровь, посевы на микрофлору, копрограмму, для которой характерны стеаторея (потеря жира достигает 50 г в сутки), креаторея, амилорея, положительные функциональные абсорбционные тесты с ксилозой, йодидом калия, глюкозой. В синовиальной жидкости количество лейкоцитов колеблется от 5 до 20000 клеток/мл.
Инструментальные методы исследования (ЭКГ, Эхо-КГ, рентгенография и компьютерная томография органов грудной клетки, брюшной полости, суставов, ЦНС и т.д.) позволяют оценить распространенность и тяжесть системных проявлений БУ, а также получить полезную информацию для проведения весьма сложной дифференциальной диагностики, которую проводить с заболеваниями, протекающими с суставным синдромом и/или синдромом мальабсорбции: болезнь Крона, реактивные артриты, ревматоидный артрит, спондилоартропатии, глютеновая энтеропатия (целиакия), туберкулез тонкой кишки, лимфома/лимфосаркома тонкой кишки, дивертикулярная болезнь кишечника, первичный и вторичный иммунодефицит с кишечной инфекцией, вызванной Mycobacterium avium, холероподобная диарея (синдром Вернера-Морисона).
Предложен следующий алгоритм верификации диагноза при подозрении на БУ, который авторы обзора назвали «стратегия диагностики БУ с помощью ШИР-реакции и ПЦР-диагностики» [9]:
1) ЭГДС с биопсией слизистой 12-перстной кишки и гистологическим исследованием биоптата с постановкой ШИК-реакции + ПЦР-диагностика; иагноз БУ считается доказанным, если оба теста положительные.
2) В тех случаях, когда положительным является только один из двух тестов, диагноз БУ считается вероятным тогда исследуют (ШИК-реакция + ПЦР-диагностика) другие биологические ткани и среды вплоть до биопсии печени, селезенки, легких, эндокарда, миокарда, межпозвонковых дисков, однако обычно ограничиваются, в зависимости от локализации процесса, анализами синовиальной жидкости и/или биоптата синовиальной оболочки; цереброспинальной жидкости (даже в отсутствие явных неврологических проявлений!), плеврального выпота, перикардиального выпота, лимфатических узлов, костного мозга, слезной жидкости, слюны, крови, кала; диагноз БУ считается доказанным, если оба теста положительные.
Существует и модификация этой стратегии при наличии артрита [26]:
1) На первом этапе проводится ПЦР-диагностика образцов синовиальной жидкости, слюны и кала; диагноз БУ считается доказанным, если все три теста положительные.
2) При положительном одном или двух ПЦР-тестах диагноз БУ считается вероятным, и тогда проводят ЭГДС с биопсией слизистой 12-перстной кишки и гистологическим исследованием биоптата с постановкой ШИК-реакции + ПЦР-диагностика; диагноз БУ считается доказанным, если положителен тест с ШИК-реакцией или оба теста положительны; в случае положительного ПЦР-теста и отрицательного теста с ШИК-реакцией диагноз БУ остается вероятным.
3) См. пункт 2 предыдущего варианта стратегии.
Лечение.
До окончательного выяснения этиологии БУ, а это произошло чуть более 20 лет назад, заболевание считалось неизлечимым. Диагноз устанавливался обычно во второй стадии болезни, то есть спустя 5-10 лет от появления первых симптомов. Больные умирали через 1-2 года после появления манифестной клинической картины: тяжелая желудочно-кишечная диспепсия, синдром мальабсорбции, кахексия, поражение внутренних органов.
Рациональная длительная антибиотикотерапия существенно улучшила прогноз при БУ. Чаще всего в лечении БУ используют тетрациклины, полусинтетические пенициллины, цефалоспорины, макролиды, фторхинолоны, метронидазол. Наиболее эффективными оказались препараты тетрациклинового ряда. Первоначально использовали тетрациклин в дозе 1 г/сут в течение 4-6 месяцев (до наступления ремиссии). Затем, для консолидации ремиссии, применяли альтернативную (прием препарата через день) или интермиттирующую (прием препарата 3 дня в неделю с перерывом 4 дня) схемы лечения тетрациклином в течение 9-18 месяцев [3, 22].
Вместо тетрациклина в настоящее время назначают метациклина гидрохлорид (рондромицин) по 0,15 г 2 раза в день или доксициклин (вибрамицин) по 0,1 2 раза в день в течение 3-5 месяцев с переходом на интермиттирующую схему на 9 месяцев.
С 2008 года в лечении БУ используют инфузии цефтриаксона в дозе 2 г в сутки или меропенема в дозе 3 г в сутки на протяжении 2-3 недель, а в дальнейшем переходят на пероральный прием бисептола или его аналога (триметоприм 160 мг + сульфаметоксазол 800 мг) по 1 таблетке 2 раза в день в течение 12 месяцев [20]. При поражении ЦНС суточную доза цефтриаксона увеличивается до 4 г (по 2 г 2 раза в сутки), а меропенема до 6 г (по 2 г 3 раза в сутки). Использование цефтриаксона и меропенема, а затем бисептола (ко-тримоксазол) позволяет достичь длительной ремиссии (до 5-10 лет) [7, 10].
При поражении ЦНС используется также следующая схема лечения: 1,2 млн ЕД бензилпенициллина (пенициллин G) и 1 г стрептомицина парентерально ежедневно в течение 2 недель с последующим назначением бисептола (ко-тримоксазола) дважды в день в течение 1-2 лет до отрицательного результата ПЦР и исчезновения Tropheryma whippelei в биоптатах из двенадцатиперстной кишки. Такая длительная терапия считается наиболее успешной в плане профилактики поражения ЦНС. В случаях, рефрактерных к антибиотикотерапии, показано назначение гамма-интерферона.
При выраженной системности процесса, наряду с антибиотикотерапией, назначают глюкокортикостероиды в дозе 30-40 мг/сут с последующим постепенным снижением дозы до 5-7,5-10 мг/сут при достижении устойчивого положительного эффекта.
Для коррекции синдрома мальабсорбции в дополнение к базисной терапии пациентам назначают диету, обогащенную животным белком до 150 г в сутки при ограничении жиров до 30 г в сутки, а также используют смеси для энтерального питания, парентерально вводят альбумин, смеси аминокислот.
При синдроме мальдигестии назначают ферментные препараты, высоко- дозированные по уровню липазы («Креон 25000» из расчета 25000-50000 ЕД липазы на прием после еды). Большое внимание уделяют коррекции водно-электролитного баланса, дефицита витаминов, железа, меди, марганца.
Лечение диареи при БУ представляет собой сложную задачу, так как его приходится проводить на фоне длительной антибактериальной терапии, что неизбежно ведет к дисбактериозу кишечника и антибиотик-ассоциированной диарее, которую чаще всего вызывает Clostridium difficile. Для профилактики и лечения дисбактериоза кишечника назначают пробиотики – предпочтительнее препараты, содержащие Saccharomyces spp., так как эти дрожжеподобные грибки устойчивы к действию антибиотиков, а также синтезируют протеолитический фермент, разрушающий токсин А, который продуцирует Clostridium difficile. Препарат «Энтерол» содержит Saccharomyces boulardii. Его назначают по 1 капсуле 2 раза в день после еды. Хилак форте (концентрат продуктов обмена веществ нормальной микрофлоры кишечника) также способствует устранению дисбактериоза (50 капель 3 раза в день до еды).
В качестве констипирующих средств, наряду с ферментными препаратами, применяют энтеросорбенты на основе смектита (диосмектит). Смекту или неосмектит назначают по 1 пакетику 3 раза в день через 2 часа после еды. Лекарства, подавляющие двигательную функцию кишечника (лоперамид, имодиум), при БУ не показаны
Эффективность терапии оценивают клинически и гистологически – морфологическим признаком положительного эффекта служит исчезновение пенистых макрофагов в биоптатах слизистой оболочки тонкой кишки.
Стойкая ремиссия в течение 5-10 лет наступает приблизительно у трети больных.
Случай из практики 1 [1].
Больной А., 23 года, в течение последних двух лет предъявлял жалобы на боли в суставах, в том числе локтевых и лучезапястных, которые сопровождались повышением температуры тела до 37,1-37,8°С. Наблюдался у квалифицированного ревматолога с диагнозом «ревматоидный артрит».
Через 14 месяцев болезни у пациента появились эпизоды диареи, начал терять в весе (около 10 кг за год). Отсутствие динамики ревматического заболевания и эффекта от проводимой терапии позволило предположить симптоматический характер артрита, и пациент был направлен на консультацию в региональный центр патологии кишечника.
При поступлении больной жаловался на боли в верхних отделах живота, тошноту и периодическую рвоту, жидкий стул 2-3 раза в сутки, потерю массы тела, слабость, артралгии. Больному проведена фиброгастродуоденоскопия, при которой в двенадцатиперстной кишке выявлены изменения, характерные для дуоденита. Выполнена биопсия слизистой 12-перстной кишки. Проведена колоноскопия для исключения болезни Крона и неспецифического язвенного колита. Выявлен сегментарный колит, взята биопсия. Выполнен анализ на ВИЧ (результат отрицательный). По данным компьютерной томографии у больного обнаружено утолщение стенок тонкой кишки и увеличение брыжеечных лимфоузлов.
При гистологическом исследовании как в двенадцатиперстной, так и в толстой кишке установлена значительная инфильтрация слизистой оболочки крупными пенистыми РАS-положительными макрофагами, расширение лимфатических сосудов.
Диагноз клинический: болезнь Уиппла с поражением тонкой и толстой кишки, лимфатических узлов брюшной полости, 2 стадия, синдром кишечной диспепсии, синдром мальабсобции, артралгия, субфебриллитет.
Пациенту назначен тетрациклин 1,0 в сутки, «Пангрол 20000» 3 раза в сутки, «Тотема» 1 питьевая ампула 2 раза в день, витамины. На фоне лечения состояние пациента значительно улучшилось, уменьшились боли в животе, нормализовался стул, исчезли артралгии, нормализовалась температура тела. Была дана рекомендация продолжить антибиотикотерапию. При контрольном осмотре через 3 месяца у больного жалобы отсутствуют, набрал 5 кг массы тела, отмечает кратковременные эпизоды диареи и слабости. Дополнительно рекомендованы пробиотики, витамины, микроэлементы.
Диспансерное наблюдение через 6 и 12 месяцев показало отсутствие рецидивов, удовлетворительное самочувствие, восстановление массы тела.
Случай из практики 2 [13].
Мужчина 60 лет поступил в клинику в марте 2008 года. В течение последних 14 лет неоднократно госпитализировался в отделение ревматологии в связи с рецидивами полиартрита и лихорадки. При поступлении передвигался с помощью костылей. Симптомы желудочно-кишечной диспепсии отсутствовали. Первый эпизод артралгии был зарегистрирован в 1994 году. Наблюдался с диагнозом серонегативный спондилоартрит (suspitio ревматоидный артрит). В течение 4 лет принимал НПВП, которые уменьшали болевой синдром и сокращали периоды обострений. В 2000 году развился полиартрит с поражением крупных и средних суставов конечностей, выраженным болевым синдромом, утренней скованностью. Был выставлен диагноз «серонегативный ревматоидный полиартрит» и назначены глюкокортикостероиды (ГКС) и НПВП. В 2001 году присоединились миалгии, полинейропатия. Лабораторные данные: сдвиг лейкоцитарной формулы влево, лимфоцитопения, СОЭW 75 мм/ч, СРБ 45 мг/л, гемоглобин 121 г/л, сывороточное железо 27 μг/100 мл, фибриноген 600 мг/100 мл, C3 141 мг/100 мл, C4 25 мг/100 мл, РФ и АНА не обнаружены. Проведено эндоскопическое исследование желудка и 12-перстной кишки. В биоптате слизистой нисходящего отдела 12-перстной кишки в зоне собственной пластинки обнаружены PAS-позитивные пенистые макрофаги и депозиты липидов. Эти данные позволили диагностировать БУ без гастроинтестинальных проявлений. Назначены: доксициклин 100 мг 2 раза в день, метилпреднизолон 8 мг в день, метотрексат 5 мг в неделю. Антибиотикотерапия была продолжена амбулаторно в течение 4 месяцев. Получен положительный эффект с быстрым выходом на ремиссию в течение 3 лет. В 2004 и 2006 годах развились обострения суставного синдрома, которые были купированы метилпреднизолоном и циклофосфамидом.
В феврале 2008 года возник рецидив болезни в виде полиартрита с выраженной слабостью, болями в грудной клетке, одышкой, сердцебиением, но также без гастроинтестинальных проявлений. Диагноз БУ был подтвержден клиническими и лабораторными методами. Рентгенологически выявлены: остеоартрит коленных суставов, остеопороз, экссудативный плеврит. На Эхо-КГ – кальцификация бикуспидального аортального клапана без признаков вегетаций. Гемокультура отрицательная. Паразитарная патология исключена. Проведена ПЦР-диагностика в реальном времени (real-time PCR) биопсийного материала и выявлены гены hsp65 (GenBank № AF184091) и 16S rRNA (GenBank № AF202891) Tropheryma whippelei. Назначены бисептол по 2 таб 2 раза, НПВП. Получен положительный эффект. Рекомендована поддерживающая терапия бисептолом по 1 таб 2 раза на 1 год. Контроль эффективности терапии – по данным биопсии слизистой 12-перстной кишки.
Случай из практики 3 [2].
Мужчина средних лет считает себя больным с ноября 2001 г., когда появились геморрагические высыпания на ногах, боли в голеностопных суставах. Наблюдался в поликлинике по месту жительства с диагнозом «геморрагический васкулит» (диклофенак 7 дней). На этом фоне стали нарастать отеки нижних конечностей и больной прекратил прием препарата. Затем появились слабость, поносы после приема пищи и в ночное время до 10 раз в сутки, урчание, вздутие живота, стал терять в весе. В апреле 2002 г. самочувствие резко ухудшилось, стали беспокоить головокружения, прогрессировала слабость. Госпитализирован в клинику, где находился с 05.04.2002 по 07.06.2002 г., с подозрением на желудочно-кишечное кровотечение. Выписан с диагнозом «железодефицитная постгеморрагическая анемия»; синдром мальабсорбции с гиперкатаболическим синдромом и экссудативной энтеропатией (безбелковые отеки, асцит, анасарка, гидроторакс). Лечение: препараты железа, витамин В12, фолиевая кислота, аспаркам, ампициллин, лоперамидом, панкреатином, одногруппная свежезамороженная плазма, эритроцитарная масса, аминокровин. Состояние больного улучшилось: уменьшилась слабость, исчезли периферические отеки, купирована диарея, стабилизирована масса тела. При выписке: гемоглобин – 67 г/л; общий белок – 45,7 г/л; альбумин – 30,9 г/л; сывороточное железо – 2,47 ммоль/л; остальные показатели – в пределах нормы. Амбулаторно: препараты железа, фолиевая кислота, витамин В12. Через 3 недели наступило ухудшение состояния: слабость, боли в животе, частый жидкий стул. Госпитализирован. Лечение: антибактериальная терапия, препараты железа. Выписан из стационара с прежним диагнозом (гемоглобин 75 г/л; сывороточное железо составляло 7,2 ммоль/л). Амбулаторно: препараты железа, панкреатин. С 15.12.2002 г. резкая слабость, головокружение, боли в животе, диарея, боли в коленных и голеностопных суставах – с трудом передвигался. В начале января 2003 г. госпитализирован диагнозом «железодефицитная анемия». Вредных привычек не имел. Наследственность не отягощена. Аллергологический анамнез без особенностей.
Состояние тяжелое, самостоятельно передвигаться не мог, заторможен. Кожные покровы бледные, тургор резко снижен.. Масса тела – 36 кг, длина тела – 170 см. Крайняя степень кахексия – индекс Кетле 12,5 кг/м2. В правой аксиллярной области два плотных лимфатических узла диаметром до 1,5 см, отеки голеней. Физикальные признаки синдрома плеврального выпота справа. Тоны сердца приглушены, ритм правильный. Систолический шум на верхушке. ЧСС – 80 ударов в минуту, артериальное давление – 90/60 мм рт. ст. Язык сухой, обложен белым налетом. Живот втянут, при пальпации безболезненный, с урчанием по ходу кишечника при пальпации. Печень выступает из-под края реберной дуги на 2 см, умеренно плотная, ровная, безболезненная. Селезенка не увеличена. Стул до 6-10 раз в сутки, темного цвета.
Анализ крови общий: эритроциты 3,6 ´ 1012/л; лейкоциты 9,3 ´ 109/л; гемоглобин 51 г/л; гематокрит 12,6%; тромбоциты 674 ´ 109/л. Биохимический анализ крови: АСТ 48,7 ед/л; АЛТ 232 ед/л; общий белок 45,7 г/л; альбумины 30,9 г/л; глюкоза 4,6 ммоль/л. На ЭКГ синусовый ритм, ЧСС 80 в мин. Гипертрофия правого предсердия. Депрессия ST во всех отведениях. Зубец Т сглажен. Рентгенография органов грудной клетки: синдром плеврального выпота справа (жидкость до 6-го ребра), очаговая двусторонняя пневмония. ЭГДС: острые эрозии пищевода, хронический гастродуоденит.
Лечение: ципрофлоксацин 0,25 г 2 раза в день; панкреатин по 2 таб 3 раза в день; лоперамид по 1 таб 2-3 раза в день; внутривенно капельно: 5% глюкоза 400,0 мл; витамин В6 5% 2,0 мл; витамин С 5% 10,0 мл; рибоксин 5% 10,0 мл; аспарагинат калия и магния 10,0 мл; полиглюкин 400,0 мл; альбумин 10% 100,0 мл.
Несмотря на проводимую терапию состояние больного прогрессивно ухудшалось и на 4-й день госпитализации он скончался. Учитывая полисистемность поражения: диарею, гипотрофию, повторяющиеся боли в животе, артралгии, эпизоды желудочно-кишечных кровотечений, развитие энцефалопатии, лимфаденопатии, кардиомиопатии, плеврита, очаговой пневмонии, положительный эффект от антибактериальной терапии при предыдущих обострениях, был поставлен диагноз: хроническая энтеропатия (интестинальная липодистрофия, болезнь Уиппла), синдром мальабсорбции, кахексия, полигландулярная недостаточность, вторичная кардиомиопатия, очаговая пневмония, плеврит, энцефалопатия.
Патологоанатомический диагноз: интестинальная липодистрофия (болезнь Уиппла) с поражением тонкой кишки, парааортальных лимфоузлов и лимфоузлов брыжейки тонкой кишки; бородавчатый эндокардит митрального клапана; кровоизлияния в слизистую пищевода, желудка, тонкой кишки; малокровие и дистрофические изменения внутренних органов. Двусторонняя очаговая пневмония. Фибринозный плеврит справа. Истощение. Диагноз подтвержден при микроскопическом исследовании секционного материала. В собственной пластинке тонкой кишки и в лимфатических узлах брыжейки тонкой кишки найдены скопления крупных макрофагов с пенистой цитоплазмой; в цитоплазме макрофагов ШИК-положительные включения.
Литература
1. Дорофеев, А.Э. Болезнь Уиппла: клиника, диагностика, лечение / А.Э. Дорофеев, О.А. Рассохина // Новости медицины и фармации. Гастроэнтерология (Украина). – 2011. – № 358. – С. 3-4.
2. Евдокимова, А.Г. Клинический случай прижизненной диагностики болезни Уиппла / А.Г. Евдокимова [и др.] // Медицинский вестник. – 2007. – № 388; http://www.medvestnik.ru/issue/?id=31.
3. Логинов, А.С. Болезнь Уиппла: результаты длительного наблюдения / А.С. Логинов, А.И. Парфенов, Н.И. Полев // Тер. арх. – 1998. – Т. 70, № 9. – С. 35-41.
4. Amsler, L.P. Prevalence of Tropheryma whipplei DNA in patients with various gastrointestinal diseases and in healthy controls / L.P. Amsler [et al.] // Infection. – 2003. – Vol. 31. – P. 81-85.
5. Ayoub, W.T. Bone destruction and ankylosis in Whipple’s disease / W.T. Ayoub [et al.] // J. Rheumatol. – 1982. – № 9. – P. 930-31.
6. Benoît, D. Whipple's Disease: a Macrophage Disease // D. Benoît[et al.] // Clinical and Vaccine Immunoljgy. – 2006. – Vol. 13, № 2. – P. 170-78.
7. Boulos, A. Antibiotic suspectibility of Troferima wippelei in MRC5 cells / A. Boulos, J.M. Rolain, D. Raoult // Antimicrob. Agents Chemother. – 2004. – Vol. 48. – P. 747-52.
8. Canoso, J.J. Whipple's disease and ankylosing spondylitis simultaneous occurrence in HLA-B27 positive male / J.J. Canoso, M. Saini, J.A. Hermos // J. Rheumatol. – 1978. – Vol. 5. – P. 79-84.
9. Fenollar, F. Whipple’s Disease: review article / F. Fenollar, X. Puéchal, D. Raoult // N. Engl. J. Med. – 2007. – Vol. 356. P. 55-66.
10. Feurle, G.E. Efficacy of ceftriaxone and meroprnem as initial therapies in Whippe’s disease / G.E. Feurle, N.S. Junga, T. Marth // Gastroenterology. – 2010. – Vol. 138. – P. 478-86.
11. Mahnel, R. Immunosuppressive therapy in Whipple’s disease patients is associated with the appearance of gastrointestinal manifestations / R. Mahnel [et al.] // Am. J. Gastroenterol. – 2005. – Vol. 100. – P. 1167-73.
12. Maibach, R.C. Detection of Tropheryma whippelii DNA in feces by PCR using a target capture method / R.C. Maibach, F. Dulty, M. Altwegg // J. Clinic. Microbiology. – 2002. – Vol. 40, № 7. – P. 2466-71.
13. Mancini, F. Fourteen years of severe arthralgia in a man without gastrointes-tinal symptoms: atypical Whipple's Disease / F. Mancini [et al.] // J. Clin. Microbiol. – 2009. – Vol. 47, № 2. – P. 492-95.
14. Marth, T., Raoult D. Whipple’s disease / T, Marth, D. Raoult // Lancet. – 2003. – № 361. – P. 239-46.
15. Misbuh, R. Whipple’s disease revisited / R. Misbuh, N.P. Mapstone // J. Clin. Pathol. – 2000. – № 53. – P. 750-55.
16. Puite, R.H. Whipple's disease / R.H. Puite, H. Tesluk // Am. J. Med. – 1955. – Vol. 19. – P. 383-400.
17. Raoult, D. Cultivation of the bacillus of Whipple disease / D. Raoult [et al.] // N. Engl. J. Med. – 2000. – № 342. – P. 620-25.
18. Relman, D.A. Identification of the uncultured bacillus of the Whipple disease / D.A. Relman [et al.] // N. Engl. J. Med. – 1992. – № 327. – P. 293-301.
19. Richardson, J.G. Tropheryma whippelii as a cause of afebrile culture-negative endocarditis: the evolving of Whipple’s disease / J.G. Richardson [et al.] // J. Infect. – 2003. – Vol. 47, № 2. – P. 760-66.
20. Schneider, T. Whipple disease: new aspects of pathogenesis and treatment / T. Schneider [et al.] // Lancet Infect. Dis. – 2008. – Vol. 8. – 179-90.
21. Schneider, T.A. Treatment of refractory Whipple disease with interferon-gamma / T.A. Schneider // Ann. Intern. Med. – 1998. – Vol. 129. – P. 875-77.
22. Singer, R. Diagnosis and treatment of Whipple’s disease (review) / R. Singer // Drugs. – 1998. – № 55. – P. 699-704.
23. Whipple, G.H. A hitherto undescribed disease characterized anatomically by deposits of fat and fatty acids in the intestinal mesenteric lymphatic tissues / G.H. Whipple // Bull. John. Hopk. Hosp. – 1907. – Vol. 18. – P. 382-91.
24. Wilson, K.H. Phylogeny of the Whipple’s disease – associated bacterium / K.H. Wilson [et al.] // Lancet. – 1991. – № 381. – P. 474-75.
25. Zinkernagel, A.S. Marginal and subgingival plaque – a natural habitat of Tropheryma whipplei? / A.S. Zinkernagel [et al.] // Infection. – 2003. – Vol. 31. – P. 86-91.
26. Puéchal, X. Whipple disease / X. Puéchal // ARD. – 2013. – Vol. 72, № 6. – 797-803.
27. Fénollar, F. Value of Tropheryma whipplei quantitative polymerase chain reaction assay for the diagnosis of Whipple disease: usefulness of saliva and stool specimens for first-line screening / F. Fénollar [et al.] // Clin. Infect. Dis. – 2008. – Vol. 47. – P. 659-67.
28. Schöniger-Hekele, M. Tropheryma whipplei in the environment: survey of sewage plant influxes and sewage plant workers / M. Schöniger-Hekele [et al.] // Appl. Environ. Microbiol. – 2007. Vol. 73. – P. 2033-35. Dobbins, W.O. HLA antigens in Whipple’s disease / W.O. Dobbins // Arthritis Rheum. – 1987. – Vol. 30. – P. 102-5.
Комментарии
Отправить комментарий