Забудьте об индивидуальной медицине ...(перевод статьи J.S. Smolen, D. Aletaha, 2014)
Smolen, J.S.
Forget
personalised medicine and focus on abating disease activity / J.S. Smolen,
D. Aletaha // Ann. Rheum. Dis. – 2013. – Vol. 72. – P. 3-6.
Перевод статьи "Забудьте об индивидуальной медицине и сосредоточтесь на снижении активности болезни"
Перевод статьи "Забудьте об индивидуальной медицине и сосредоточтесь на снижении активности болезни"
Резюме. В данном сообщении мы суммируем три отличных друг от друга массива данных, указывающих на то, что современные подходы к лечению биологическими агентами, направленные на различные молекулы или клетки, одинаково эффективны при РА и имеют сходные целевые популяции пациентов. Поэтому отдельные биологические эффекты, обусловленные этими вариантами целевой терапии, не могут рассматриваться в качестве различий в ответах на лечение. Более того, имеющиеся в настоящее время в нашем распоряжении биомаркеры или их комбинации не дают нам дополнительной полезной информации сравнительно с той, что мы получаем от оценки активности болезни. Тонкие и новаторские дизайны исследований, как мы надеемся, позволят в будущем найти подходящие биомаркеры, отражающие динамику болезни на молекулярном или клеточном уровнях. В настоящее же время клиницисты должны сфокусироваться исключительно на оценке активности болезни, а в качестве цели иметь достижение ремиссии или как можно более быстрое снижение активности процесса.
Синовит (паннус) представляет собой ключевое патологическое образование при РА, которое ведет к формированию основных проявлений болезни (припухание, боль, утренняя скованность), столь характерных для данного заболевания и обусловленных разрушением хряща и кости [1]. Боль, скованность, припухание и разрушение суставов ведут в свою очередь к функциональным нарушениям, влияющим на качество жизни больных РА и трудоспособность. К счастью, в настоящее время, больные РА и ревматологи имеют в арсенале лечения разнообразные болезнь-модифицирующие антиревматические препараты (БМАРП). К ним относятся, в первую очередь, т.н. «большие молекулы» или биологические агенты (биоагенты) и хорошо изученные малые синтетические молекулы, а также ряд новых малых молекул, появившихся в последнее время и позволяющих иметь по сравнению с недалеким прошлым больше вариантов целевой терапии [2, 3]. Эффективность всех этих лекарственных средств, позволяет считать, что больные РА уже сейчас имеют отличные перспективы в плане ремиссии или низкой активности болезни и будут иметь еще большие перспективы в ближайшем будущем [4].Тем не менее, многие пациенты сохраняют устойчиво высокую активность болезни и нарастающее снижение трудоспособности. Мнение о том, что это является результатом низкой доступности оптимальной терапии, например, недостаток возмещения затрат на лечение биоагентами может иметь место, но он не является основной причиной данной проблемы. Скорее отсутствие приверженности к целевому лечению РА и является тайным виновником создавшейся ситуации. Исследования TICORA, BeSt и более современное CAMERA являются лучшим подтверждением этой точки зрения [2, 5-7]. Ряд наблюдений хорошо согласуются со следующим выводом: анализ фармакологического анамнеза больных РА с недостаточной эффективностью метотрексата, включенных в клинические исследования показал, что несмотря на большую длительность болезни не весь арсенал БМАРП был использован в лечении этих больных [8-13].
Тот факт, что болезнь в течение длительного периода времени находится под хорошим контролем необходимо обосновать детальными сведениями из истории болезни, однако эти данные в большинстве случаев отсутствуют. По нашему опыту, мы хорошо знаем, что в ряде клинических испытаний БМАРП пациенты могли иметь затяжной активный процесс, создающий существенные погрешности в оценке выраженности исходного повреждения суставов при включении больных в исследование (таблица 1).
Таблица 1 – Средняя длительность применения БМАРП в ряде
клинических испытаний (случайная выборка)
Таким образом, тысячи больных РА, имевших активный процесс и высокую степень деструкции суставов, включенных в клинические исследования в разных странах, получали, по разным причинам, весьма ограниченное число БМАРП за весь период болезни. С другой стороны, даже в тех случаях когда ревматологам были доступны все лицензированные лекарства, они по-прежнему плохо представляли себе тактику выбора и смены БМАРП. Заметим тот факт, что все биоагенты имеют приблизительно одинаковую частоту хороших исходов при использовании в качестве оценки эффективности лечения критериев ACR50 или ACR70 [17].
Многие врачи считают, что лучшие маркеры – в идеале биомаркеры – позволят выбрать оптимальный препарат для лечения РА. Действительно, индивидуализированный подход, основанный на использовании биомаркеров в лечении РА и других заболеваний, является в настоящее время господствующим [18-21]. Тем не менее, необходимо задать вопрос о том являются ли биомаркеры тем инструментом, который позволит решить проблему выбора БМАРП? Для ее решения, рассмотрим три аспекта, связанных со следующим глобальным вопросом. Все ли пациенты имеют одинаковые шансы положительного ответа на имеющиеся в арсенале ревматолога БМАРП?
Другими словами, является ли одна группа ответчиков отличной от других групп или эти группы перекрываются? [1] Можно ли утверждать, что у неответчиков на блокаторы фактора некроза опухолей альфа (ФНО-a), любой другой биоагент будет работать так же, как и блокаторы ФНО-a? Или, коль шансы на успех при лечении РА конкретным биоагентом отличны для разных больных, то у неответчиков на один вариант целевой терапии можно ожидать хороший ответ на другие биоагенты с иным механизмом действия.
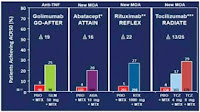
В реальности анализируя сопоставимые группы больных РА, продолжающих получать метотрексат после завершения целевой терапии каким-либо биоагентом, мы видим другое – результаты лечения по критериям ACR50 на 24 неделе наблюдения весьма схожи, независимо от препарата, используемого для целевой терапии (рисунок 1). Очевидно, что это просто визуальное сравнение опубликованных данных, а не попарное прямое сравнение, однако и прямые попарные сравнительные исследования подтвердили, что «визуальная оценка» может быть достаточно информативной [25].
Рисунок 1 – Различные биоагенты (голимумаб, абатацепт, ритуксимаб, тосилизумаб) в комбинации с метотрексатом имеют сходную клиническую эффективность по ACR50 и
влияют на конечный этап патогенеза РА [22-24].
Следует отметить, что первичная конечная точка эффективности лечения в исследовании голимумаба была определена на 14 неделе и включала как больных, получавших синтетические БМАРП, так и не получавших их. Данные же использованные для обеспечения сопоставимости с другими испытаниями и приведенные на рисунке 1, относятся к средней конечной точке, определенной на шестом месяце лечения у больных, получавших кроме голимумаба еще и метотрексат [11]. Числа в нижней части каждого столбца показывают число пациентов, получивших лечение (знак дельта обозначает разницу между эффективностью целевой терапии и плацебо-терапией).
Рисунок 2 – схематическое представление ряда целевых молекул и клеток, участвующих патогенезе РА, завершающий этап которого обусловлен ФНО и ИЛ-6.
На рис. 2 показаны основные молекулы и клетки, участвующие в патогенезе РА и являющиеся «мишенями» для различных биоагентов. В конечном счете все они, разными путями, влияют на продукцию провоспалительных цитокинов семейства ФНО (преимущественно ФНО-a) и интерлейкинов (преимущественно ИЛ-6). Поэтому можно предположить сходную клиническую эффективность разных по механизму действия биоагентов! Хотя в некоторых наблюдательных исследованиях было показано, что при неэффективности одного или даже двух ингибиторов ФНО-a, хорошая клиническая эффективность в лечении РА может быть получена при использовании биоагентов с другим механизмом действия [26, 27]. Однако такие исследования, и это следует подчеркнуть, имеют ряд ограничительных факторов.
Во-первых, и наблюдательные исследования и анализ регистров не оперируют рандомизированными группами пациентов. Кроме того, регистры исходно были предназначены для изучения отдаленных аспектов безопасности лекарственной терапии в реальной клинической практике.
Во-вторых, например, в исследовании, основанном на данных регистра, в котором утверждается, что ритуксимаб более эффективный препарат, неже-ли ингибиторы ФНО-a у больных в первичной их неэффективностью, почти 40% из них получали монотерапию ингибиторами ФНО-a, т.е. этим больных не назначалась синтетические БМАРП [2]. Однако, достаточно убедительно доказано, что лечение РА комбинацией «ингибитор ФНО-a + метотрексат» показывает существенно большую эффективность, чем монотерапия ингибитором ФНО-a. Поэтому такое сравнение нельзя признать клинически и статистически корректным [29, 29].
В-третьих, систематические литературные обзоры и парные мета-анализы клинических испытаний, также не находят существенных различий в клинической эффективности разных по механизму действия биоагентов [30-31].
По этим причинам в настоящее время нет убедительных данных в пользу того, что неответчики на первичную терапию ингибиторами ФНО-a могут дать адекватный ответ на другие биоагенты, которые с ними сравнивали. Нет аналогичных доказательств и для различных подгрупп больных РА [2].
Ответ на большинство биоагентов с разным механизмом действия уменьшается в зависимости от числа проведенных предварительных курсов ингибиторами ФНО-a. Ответ на лечение РА большинством биоагентов уменьшается с увеличением числа неудачных попыток предшествующей терапии ингибиторами ФНО-a. Но эффективность нового метода лечения в разных подгруппах больных не должна уменьшаться с увеличением числа попыток предшествующего лечения ингибиторами ФНО-a.
К сожалению, за одним исключением, имеющиеся в настоящее время данные позволяют утверждать, что эффективность лечения новыми биоагентами уменьшается с увеличением числа попыток предшествующей терапии ингибиторами ФНО-a. Такое снижение наблюдается при использовании ритуксимаба и абатацепта [32, 33]. Эффективность лечения голимумабом также уменьшалась после предварительной терапии тремя различными ингибиторами ФНО-a сравнительно с предварительной терапией одним или двумя ингибиторами ФНО-a [34]. Такое снижение эффективности терапии после неудачных попыток лечения ингибиторами ФНО-a можно объяснить увеличением общей рефрактерности к любой терапии при увеличении числа ее циклов, но это еще однозначно не установлено. Этому положению пока, вроде бы, противоречит исследование тоцилизумаба, в котором не установлено, что при увеличении числа попыток предварительного лечения ингибиторами ФНО-a эффективность тоцилизумаба падает. Однако такие данные получены лишь в одном исследовании и могут быть игрой случая.
Совсем недавно появилась еще одна публикация о том, что ритуксимаб может быть эффективным у неответчиков на один из ингибиторов ФНО-a [35]. В связи с этим утверждением возникает закономерный вопрос: если различие в механизмах действия биоагентов является основной причиной успешного лечения, то почему этот принцип не распространяется на разные ингибиторы ФНО-a? Иными словами, почему при первичной неэффективности ингибитора ФНО-a последующие курсы другими ингибиторами ФНО-a также не дают положительного результата? Кроме того, в настоящее время отсутствуют данные о том, что больные РА, давшие положительный ответ на один из биоагентов, по крайней мере это относится к препаратам, блокирующим костимуляцию Т-клеток, и вызывающим элиминацию В-клеток, взяты из той же подгруппы больных, что и больные, у которых получен положительный ответ на второй или третий ингибиторы ФНО-a.
Комбинация биоагентов не дает дополнительных ответчиков при лечении РА. Более убедительная аргументация этого утверждения лежит в плоскости третьего положения, а именно, является ли комбинация биоагентов с разным механизмом действия более эффективной, чем каждый из них в отдельности? Если больные избирательно отвечают на один вариант терапии, но не отвечают на другой, значит они относятся к разным подгруппам пациентов и тогда комбинация биоагентов может привести к увеличению эффективности терапии.
Однако, в трех рандомизированных клинических испытаниях (РКИ) не были выявлены подобные результаты комбинированного лечения РА. В первом из них было проведено попарное сравнение монотерапии этанерцептом с комбинацией «этанерцепт + анакинра (ингибитор ИЛ-1)», причем в комбинации были использованы два варианта дозирования этанерцепта – полная и половинная дозы [14]. В исследовании не был выявлен дополнительный положительный эффект от комбинации биоагентов. Более того, в группе монотерапии этанерцептом была отмечена более высокая частота положительного ответа, чем в двух подгруппах сравнения (таблица 2) [14].
Таблица 2 – Частоты положительного ответа на терапию по критериям ACR50 и ACR70, а также частоты серьезных НПР на лекарства и инфекционных заболеваний на комбинированную терапию РА биоагентами [14-16]
Отсутствие положительного эффекта от комбинированной терапии нельзя объяснить с позиций недостаточной блокады ИЛ-1 или избыточной ингибиции ФНО-a, так как на дополнительный биологический эффект комбинации указывают развитие, как серьезных неблагоприятных побочных явлений, так и серьезных инфекционных заболеваний.
В более позднем исследовании больные с активным РА, несмотря использование этанерцепта или адалимумаба в комбинации с метотрексатом, были рандомизированы для получения ритуксимаба или плацебо. Ни один больной в этих подгруппах не достиг ответа по критериям ACR70, а ответы по критериям ACR50 были довольно низкими в обеих группах лечения (таблица 2). По сравнению с более ранним исследованием ритуксимаба у больных, которым проводилось лечение ингибиторами ФНО-a [23], доля ответчиков была незначительной. Частота серьезных неблагоприятных побочный реакций (НПР) на лекарства в этом небольшом исследовании была низкой, но существенно выше чем в группе комбинированной терапии.
В третьем РКИ, в котором оценивали комбинацию ингибитора ФНО-a (этанерцепт) и блокатора Т-клеточной костимуляции (абатацепт), статистически значимые различия по критериям ACR не были получены [36]. Более того, необходимо отметить, что в фазе двойного слепого исследования абатацепт был использован в дозе 2 мг/кг, а в фазе пролонгации терапии в существенно более высокой дозе (10 мг/кг), тем не менее не были выявлены различия в клинической эффективности сравнительно с комбинацией «этанерцепт + плацебо». Однако, серьезные побочные эффекты, в том числе серьезные инфекции, встречались гораздо чаще в группе комбинированной терапии, чем группе монотерапии.
Имеющиеся данные показывают, что разнообразные комбинации ингибиторов ФНО-a с биоагентами, влияющими на Т-клетки, В-клетки и цитокины, не приносят дополнительной пользы, напротив, возрастает риск НПР и инфекций. Это увеличение серьезных НПР и инфекций на фоне сомнительного дополнительного биологического эффекта комбинированной терапии биоагентами, а также отсутствие значимой клинической пользы, действуют весьма отрезвляюще.
Ответы, полученные на три поставленных выше вопроса, вполне между собой согласуются и предполагают, что пациенты, у которых был эффективен любой из имеющихся в нашем арсенале биоагентов, входят в одну группу реагирования на эти препараты. С чем связана близость результатов лечения при столь разных мишенях воздействия? Пока все эти патогенетические варианты могут быть сведены к некоему общему механизму, до тех пор патогенетически важным является момент того, где находится «мишень» – до или после этого общего механизма (рисунок 2).
Необходимо отметить, что ритуксимаб более эффективен у серопозитивных больных РА, нежели у серонегативных [37]. Однако, во-первых, это положение распространяется примерно на 80% серопозитивных больных РА, причем тех, которые клинически отличаются от серонегативных. И, во-вторых, в недавно проведенном мета-анализе было показано, что различия в эффективности лечения ритуксимабом серопозитивных и серонегативных больных весьма небольшие, более того, этот биоагент оказался эффективным при таких серонегативных заболеваниях, как анкилозирующий спондилит и псориатический артрит [38, 39].
По указанным причинам, индивидуальные биологические эффекты таргетной терапии нельзя принимать в расчет для объяснения различий в ответах на лечение, и, как следствие, поиск биомаркеров, позволяющих выбрать конкретную популяцию больных для целевой терапии, может быть менее убедительным, чем мы предполагаем.
Кроме того, необходимо иметь в виду, что лучшим предиктором достижения ремиссии или низкой активности заболевания является не отдельный биомаркер или их констелляция, а именно снижение активности как таковой, определяемой на основании комбинированных индексов [40], и чем выше исходный уровень активности заболевания, тем меньше шансы хорошего исхода.
Это последнее утверждение относится ко всем вариантам лечения, снова и снова наводя на мысль о наличии неких общих типов реагирования у ответчиков. Конечно, в этой ситуации поиск биомаркеров эффективного ответа должен быть продолжен, но более инновационными способами, чем это осуществлялось до сих пор, а пока необходимо признать, что не биомаркеры, а клинические маркеры являются наиболее надежными предикторами исхода и положительного ответа на проводимую терапию. Так как основной задачей лечения РА является снижение активности заболевания, а в идеале достижение ремиссии или состояния минимальной активности процесса, мы должны сосредоточиться в основном на решении этой задачи, не слишком разочаровываясь тем, что поиск биомаркеров пока не дал желаемого результата.
В свете сказанного, необходимо подчеркнуть, что даже в случаях длительной терапии БМАРП, проводимой в среднем более трех лет, несмотря на недостаточный эффект, мы не должны чрезмерно фокусироваться на биомаркерах, лишь частично ассоциированных с активностью процесса (острофазовые показатели, антитела, цитокиновый профиль), или ждать обнаружения новых биомаркеров положительного ответа [41]. В настоящее время даже тщательно отобранные биомаркеры-предикторы эффективности терапии РА не позволяют, за редким исключением [41], получить дополнительную информацию сравнительно с клинической оценкой активности болезни [42]. Более того, наступило некоторое разочарование в связи отсутствием должной чувствительности биомаркеров и их интерференции с серологическими параметрами у больных РА [43].
Таким образом, в настоящее время мы должны сконцентрироваться на снижении активности болезни в целевой терапии, которая предполагает модификацию или коррекцию терапии каждые 3-6 месяцев в тех случаях, когда улучшение (в пределах 3 месяцев) или цель, по крайней мере, низкой активности процесса (за 6 месяцев) не достигнута.
Предлагаемый подход не должен обескураживать своей простотой и не исключает поиск биомаркеров-предикторов высокой эффективности терапии РА, которые бы позволили индивидуализировать лечение. Такой подход лишь отражает современное состояние доказательной медицины по данной проблеме и предполагает, что детально продуманные и особым образом сфокусированные дизайны клинических исследований позволят выявить специфические биомаркеры, которые решат проблему выбора одного биоагента из многих существующих. До тех пор пока такие биомаркеры не будут найдены снижение активности болезни, прекращение прогрессирования повреждения суставов, максимальное улучшение функционального состояния и качества жизни больного, должны находиться в центре внимания, независимо от использования любого из вариантов биомаркерного подхода или чрезмерного внимания к режимам и схемам терапии конкретным лекарством.
Новые биомаркеры придут на смену старым, а сражение с активностью болезни останется в центре нашего внимания в лечении РА.
Литература
1. Redlich K, Smolen JS. Inflammatory bone loss: pathogenesis and therapeutic intervention. Nat Rev Drug Discov 2012; 11: 234-50.
2. Smolen JS, Landewe R, Breedveld FC, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs. Ann Rheum Dis 2010; 69: 964-75.
3. Fleischmann R. Novel small-molecular therapeutics for rheumatoid arthritis. Curr Opin Rheumatol 2012; 24: 335-41.
4. Smolen JS, Aletaha D, Bijlsma JWJ, et al. Treating rheumatoid arthritis to target: recommendations of an international task force. Ann Rheum Dis 2010; 69: 631-7.
5. Grigor C, Capell H, Stirling A, et al. Effect of a treatment strategy of tight control for rheumatoid arthritis (the TICORA study): a single-blind randomised controlled trial. Lancet 2004; 364: 263-9.
6. Van der Woude D, Visser K, Klarenbeek NB, et al. Sustained drug-free remission in rheumatoid arthritis after DAS-driven or non-DAS-driven therapy: a comparison of two cohort studies. Rheumatology (Oxford) 2012; 51: 1120-8.
7. Bakker MF, Jacobs JW, Welsing PM, et al. Low-dose prednisone inclusion in a methotrexate-based, tight control strategy for early rheumatoid arthritis: a randomized trial. Ann Intern Med 2012; 156: 329-39.
8. Keystone E, Heijde D, Mason D Jr, et al. Certolizumab pegol plus methotrexate is significantly more effective than placebo plus methotrexate in active rheumatoid arthritis: findings of a fifty-two-week, phase III, multicenter, randomized, double-blind, placebo-controlled, parallel-group study. Arthritis Rheum 2008; 58: 3319-29
9. Smolen JS, Landewe RB, Mease PJ. Efficacy and safety of certolizumab pegol plus methotrexate in active rheumatoid arthritis: the RAPID 2 study. Ann Rheum Dis 2009; 68: 797-804.
10. Kremer JM, Blanco R, Brzosko M, et al. Tocilizumab inhibits structural joint damage in rheumatoid arthritis patients with inadequate responses to methotrexate: results from the double-blind treatment phase of a randomized placebo-controlled trial of tocilizumab safety and prevention of structural joint damage at one year. Arthritis Rheum 2011; 63: 609-21.
11. Smolen JS, Beaulieu A, Rubbert-Roth A, et al. Effect of interleukin-6 receptor inhibition with tocilizumab in patients with rheumatoid arthritis (OPTION study): a double-blind, placebo-controlled, randomised trial. Lancet 2008; 371: 987-97.
12. Genovese MC, McKay JD, Nasonov EL, et al. Interleukin-6 receptor inhibition with tocilizumab reduces disease activity in rheumatoid arthritis with inadequate response to disease-modifying antirheumatic drugs: the tocilizumab in combination with traditional disease-modifying antirheumatic drug therapy study. Arthritis Rheum 2008; 58: 2968-80.
13. Emery R Fleischmann R, Filipowicz-Sosnowska A, et al. The efficacy and safety of rituximab in patients with active rheumatoid arthritis despite methotrexate treatment: results of a phase IIB randomized, double-blind, placebo-controlled, dose-ranging trial. Arthritis Rheum 2006; 54: 1390-400.
14. Genovese MC, Cohen S, Moreland L, et al. Combination therapy with etanercept and anakinra in the treatment of patients with rheumatoid arthritis who have been treated unsuccessfully with methotrexate. Arthritis Rheum 2004; 50: 1412-19.
15. Weinblatt M, Combe B, Covucci A, et al. Safety of the selective costimulation modulator abatacept in rheumatoid arthritis patients receiving background biologic and nonbiologic disease-modifying antirheumatic drugs: A one-year randomized, placebo-controlled study. Arthritis Rheum 2006; 54: 2807-16.
16. Greenwald MW, Shergy WJ, Kaine JL, ef al. Evaluation of the safety of rituximab in combination with a tumor necrosis factor inhibitor and methotrexate in patients with active rheumatoid arthritis: results from a randomized controlled trial. Arthritis Rheum 2011; 63: 622-32.
17. Smolen JS, Aletaha D, Koeller M, et al. New therapies for the treatment of rheumatoid arthritis. Lancet 2007; 370: 1861-74.
18. Bridges SL Jr. Personalized medicine in rheumatoid arthritis: hopes and challenges. Bull NYU Hosp Jt Dis 2007; 65: 174-7.
19. Verweij CL. Pharmacogenetics: Anti-TNF therapy in RA – towards personalized medicine? Nat Rev Rheumatol 2011; 7: 136-8.
20. Plenge RM, Bridges SL Jr. Personalized medicine in rheumatoid arthritis: miles to go before we sleep. Arthritis Rheum 2011; 63: 590-3.
21. Так PR A personalized medicine approach to biologic treatment of rheumatoid arthritis: a preliminary treatment algorithm. Rheumatology (Oxford) 2012; 51: 600-9.
22. Emery R Keystone E, Tony HP, et al. IL-6 receptor inhibition with tocilizumab improves treatment outcomes in patients with rheumatoid arthritis refractory to antitumour necrosis factor biologicals: results from a 24-week multicentre randomised placebo-controlled trial. Ann Rheum Dis 2008; 67: 1516-23.
23. Cohen SB, Emery P Greenwald MW, et al. Rituximab for rheumatoid arthritis refractory to anti-tumor necrosis factor therapy: Results of a multicenter, randomized, double-blind, placebo-controlled, phase III trial evaluating primary efficacy and safety at twenty-four weeks. Arthritis Rheum 2006; 54: 2739-806.
24. Genovese MC, Becker JC, Schiff M, et al. Abatacept for rheumatoid arthritis refractory to tumor necrosis factor alpha inhibition. N Engl J Med 2005; 353: 1114-23.
25. Schiff M, Fleischmann R, Weinblatt M, et al. Abatacept sc versus adalimumab on background methotrexate in RA: one year results from the AMPLE study. Ann Rheum Dis 2012; 71: 60.
26. Finckh A, Ciurea A, Brulhart L, et al. B cell depletion may be more effective than switching to an alternative anti-tumor necrosis factor agent in rheumatoid arthritis patients with inadequate response to anti-tumor necrosis factor agents. Arthritis Rheum 2007; 56: 1417-23.
27. Blom M, Kievit W, et al. Effectiveness of a third tumor necrosis factor-alpha-blocking agent compared with rituximab after failure of 2 TNF-blocking agents in rheumatoid arthritis. J Rheumatol 2011; 38: 2355-61.
28. Klareskog L, van der Heijde D, de Jager JP, et al. Therapeutic effect of the combination of etanercept and methotrexate compared with each treatment alone in patients with rheumatoid arthritis: double-blind randomised controlled trial. Lancet 2004; 363: 675-81.
29. Breedveld FC, Weisman MH, et al. The PREMIER study – a multicenter, randomized, double-blind clinical trial of combination therapy with adalimumab plus methotrexate versus methotrexate alone or фdalimumab alone in patients with early, aggressive rheumatoid arthritis who had not had previous methotrexate treatment. Arthritis Rheum 2006; 54: 26-37.
30. Nam JL, Winthrop KL, et al. Current evidence for the management of rheumatoid arthritis with biological disease-modifying antirheumatic drugs: a systematic literature review informing the EULAR recommendations for the management of RA. Ann Rheum Dis 2010; 69: 976-86.
31. Schoels M, Aletaha D, Smolen JS, et al. Comparative effectiveness and safety of biological treatment options after tumour necrosis factor alpha inhibitor failure in rheumatoid arthritis: systematic review and indirect pairwise meta-analysis. Ann Rheum Dis 2012; 71: 1303-8.
32. Kremer JM, Tony H, Так P, et alf. Eficacy of rituximab in active ra patients with an inadequate response to one or more TNF inhibitors. Ann Rheum Dis 2006; 65: 326.
33. Schiff M, Pritchard С Huffstutter JE, et al. The 6-month safety and efficacy of abatacept in patients with rheumatoid arthritis who underwent a washout after anti-tumour necrosis factor therapy or were directly switched to abatacept: the ARRIVE trial. Ann Rheum Dis 2009; 68: 1708-14.
34. Smolen JS, Kay J, Doyle MK, et al. Golimumab in patients with active rheumatoid arthritis after treatment with tumour necrosis factor alpha inhibitors (GO-AFTER study): a multicentre, randomised, double-blind, placebo-controlled, phase III trial. Lancet 2009; 374: 210-21.
35. Chatzidionysiou K, Lie E, Nasonov E, et al. Highest clinical effectiveness of rituximab in autoantibody-positive patients with rheumatoid arthritis and in those for whom no more than one previous TNF antagonist has failed: pooled data from 10 European registries. Ann Rheum Dis 2011; 70: 1575-80.
36. Weinblatt M, Schiff M, Goldman A, et al. Selective costimulation modulation using abatacept in patients with active rheumatoid arthritis while receiving etanercept: a randomised clinical trial. Ann Rheum Dis 2007; 66: 228-34.
37. Isaacs JD, Cohen SB, Emery P, et al. Effect of baseline rheumatoid factor and anticitrullinated peptide antibody serotype on rituximab clinical response: a meta-analysis. Ann Rheum Dis 2012.
38. Song IH, Heldmann F Rudwaleit M, et al. Different response to rituximab in tumor necrosis factor blocker-naive patients with active ankylosing spondylitis and in patients in whom tumor necrosis factor blockers have failed: a twenty-four-week clinical trial. Arthritis Rheum 2010; 62: 1290-7.
39. Jimenez-Boj E, Stamm TA, Sadlonova MR, et al. Rituximab in psoriatic arthritis: an exploratory evaluation. Ann Rheum Dis (epub) 2012.
40. Aletaha D, Funovits J, Keystone EC, et al. Disease activity early in the course of treatment predicts response to therapy after one year in rheumatoid arthritis patients. Arthritis Rheum 2007; 56: 3226-35.
41. Takeuchi T, Miyasaka N, Tatsuki У et al. Inhibition of plasma IL-6 in addition to maintenance of an efficacious trough level of infliximab associated with clinical remission in patients with rheumatoid arthritis: analysis of the RISING Study. Ann Rheum Dis 2012; 71: 1583-5.
42. Bakker MF, Cavet G, Jacobs JW, et al. Performance of a multi-biomarker score measuring rheumatoid arthritis disease activity in the CAMERA tight control study. Ann Rheum Dis 2012; 71: 1692-7.
43. Churchman SM, Geiler J, Parmar R, et al. Multiplexing immunoassays for cytokine detection in the serum of patients with rheumatoid arthritis: lack of sensitivity and interference by rheumatoid factor. Clin Exp Rheumatol 2012; 30: 534-542.


Комментарии
Отправить комментарий